Lan kim tuyến là nguồn dược thảo quý, có giá kinh tế cao. Nhưng do số lượng ít, mọc rải rác và bị khai thác quá mức nên cây lan kim tuyến trong tự nhiên có nguy cơ bị tuyệt chủng nếu không có biện pháp bảo tồn hiệu quả.
Mục lục
MỞ ĐẦU

Hình ảnh Lan kim tuyến – Anoectochilus setaceus Blume ngoài tự nhiên
Lan kim tuyến Anoectochilus setaceus Blume, thuộc họ Phong lan (Orchidaceae), được biết đến nhiều do khả năng ứng dụng trong y dược. Theo y học cổ truyền Trung Hoa, lan kim tuyến được dùng để điều trị bệnh tiểu đường, làm tan khối u, giảm lipase trong máu và chữa viêm gan.
Hiện nay, lan kim tuyến được đưa vào danh mục các loài đang nguy cấp thuộc nhóm IA của Nghị định 32/2006/CP, nghiêm cấm khai thác vì mục đích thương mại và được xếp vào nhóm thực vật rừng đang nguy cấp (EN A1 a,c,d) trong Sách Đỏ Việt Nam 2007.
Nghiên cứu này với mục đích thiết lập quy trình nhân nhanh lan kim tuyến (Anoectochilus setaceus) thông qua cảm ứng tạo PLBs nhằm gia tăng hệ số nhân chồi.
VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Vật liệu
Thể chồi in vitro 30 ngày tuổi của cây lan kim tuyến (Anoectochilus setaceus Blume), do Phòng Công nghệ tế bào thực vật Viện Công nghệ sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam cung cấp.
Môi trường nuôi cấy
Môi trường cơ bản Knudson C bao gồm các muối đa lượng, vi lượng theo Knudson (1946) và vitamin B5 theo Gamborg (1968), bổ sung các chất điều hoà sinh trưởng như kinetin, 2,4-D, GA3, α-NAA tùy theo từng giai đoạn nuôi cấy.
Phương pháp nghiên cứu
- Thể chồi in vitro lan kim tuyến 30 ngày tuổi (hình 2a) được khử đỉnh sinh trưởng (hình 2b) và chuyển vào 7 công thức môi trường cảm ứng tạo protocom có bổ sung 2,4-D và kinetin ở nồng độ khác nhau. Giai đoạn cảm ứng tạo PLBs được nuôi cấy trong điều kiện lỏng-lắc, 16h chiếu sáng, nhiệt độ phòng nuôi cấy 22oC.
- Các cụm PLBs tốt (tươi, chắc, màu xanh, không mọng nước, không bị biến dạng) được chuyển sang môi trường tạo chồi có sự kết hợp giữa BAP, kinetin, và GA3, α-NAA và tiếp tục nuôi cấy trong 30 ngày. Sau đó, các chồi phát triển tốt, chiều cao chồi đạt từ 2-3 cm được tách riêng và chuyển lên môi trường kích thích ra rễ.
- Cây in vitro hoàn thiện được đưa ra trồng thử nghiệm trong vườn ươm để đánh giá khả năng thích nghi của chồi trong điều kiện tự nhiên. Các thí nghiệm được lặp lại 3 lần. Số liệu thống kê phân tích theo phương pháp phân tích phương sai ANOVA bằng phần mềm SPSS.
KẾT QUẢ VÀ THẢO LUẬN
Ảnh hưởng của kinetin và 2,4 D tới khả năng hình thành PLBs từ thể chồi
Trong khi đó, ở các môi trường bổ sung kinetin đơn lẻ với các nồng độ khác nhau (0,5; 1,0; 1,5 mg/L), sự hình thành PLBs cũng như chất lượng PLBs có sự khác biệt rõ rệt. Môi trường Pr6 có sự hình thành PLBs sớm hơn so với môi trường Pr4 và Pr5 (sau 12 ngày), nhưng lại có tỷ lệ hình thành PLBs thấp nhất.
Môi trường Pr4 (bổ sung 0,5 mg/L kinetin) có tỷ lệ hình thành PLBs cao nhất, các cụm PLBs có khối lượng lớn nhất và chất lượng tốt nhất, thể hiện ở: PLBs khỏe, màu trắng xanh, nhiều thể chồi (hình 2c). Như vậy, việc bổ sung cytokinin đơn lẻ (kinetin: 0,5 mg/L) trong môi trường nuôi cấy có khả năng cảm ứng tốt nhất tạo PLBs trực tiếp từ đỉnh chồi Lan kim tuyến (Anoectochilus setaceus).
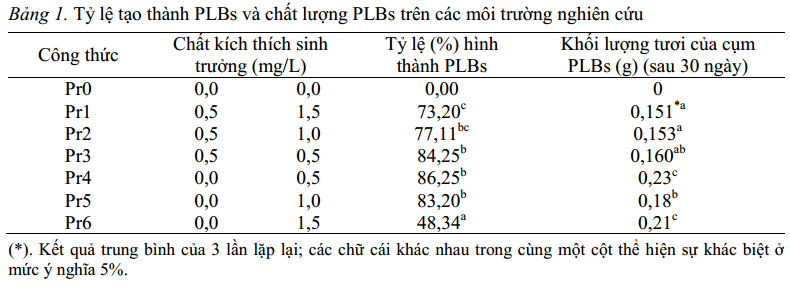
Bảng 1. Tỷ lệ tạo thành PLBs và chất lượng PLBs trên các môi trường nghiên cứu Công thức Chất kích thích sinh trưởng (mg/L)
Khả năng sinh trưởng của PLBs trong môi trường Pr4
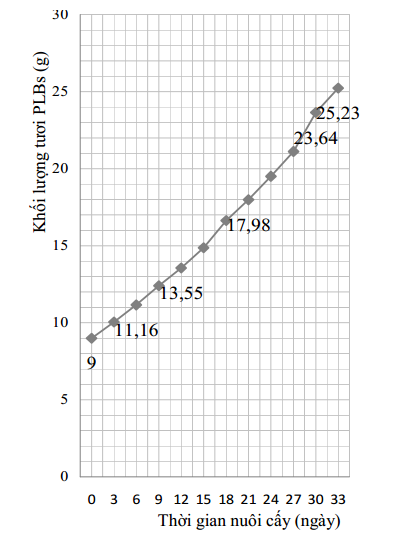
Chúng tôi tiến hành theo dõi quá trình sinh trưởng của các cụm PLBs nuôi cấy trên môi trường Pr4 trong thời gian 33 ngày (Hình 1).
![Tái sinh cây hoàn chỉnh từ PLBs 1 Tái sinh cây hoàn chỉnh từ PLBs 1]() Tái sinh cây hoàn chỉnh từ PLBs
Tái sinh cây hoàn chỉnh từ PLBs
Các cụm PLBs 30 ngày tuổi tạo ra từ môi trường Pr4, có khối lượng trung bình 0,23 gam được chuyển vào nuôi cấy trên các môi trường K0 (knudson C + 10% nước dừa + 10% dịch chiết khoai tây + 30 g/L saccaroza + 2,7 g/L gelrite), K1 (K0 + 0,5 mg/L BAP + 0,3 mg/l GA3 + 0,3 mg/L kinetin + 0,1 mg/L NAA và K2 (K0 + 0,5 mg/L NAA). Các môi trường K0, K1, K2 đều có pH=5,5, nhằm đánh giá khả năng phát sinh, sinh trưởng và tạo cây hoàn chỉnh từ PLBs lan kim tuyến.
Chúng tôi tiến hành tái sinh cây lan kim tuyến từ PLBs theo hai giai đoạn. (1) Giai đoạn tái sinh chồi từ PLBs và (2) Giai đoạn sinh trưởng chồi và tạo rễ.
Ở giai đoạn (1), các cụm PLBs được chuyển lên môi trường K0 hoặc K1 để tái sinh chồi từ cụm PLBs. Sau 7-10 ngày nuôi cấy chúng tôi nhận thấy đã tạo được chồi từ PLB (hình 2d) và sau 30 ngày nuôi cấy các cụm PLBs hình thành các chồi cao 0,5-2,5 cm, có từ 1-2 lá, chồi có màu trắng-xanh (hình 2e). Kết quả sau 30 ngày nuôi cấy trên môi trường K0 có hệ số nhân chồi cao hơn nuôi trong môi trường K1 (22±3,76 chồi/cụm PLBs so với 20,14±4,14 chồi/cụm PLBs). Kết thúc giai đoạn 1, với thời gian nuôi cấy tái sinh chồi 30 ngày, nhiều chồi vẫn nhỏ, có thể chưa kéo dài hết chồi ở cụm PLBs, nhưng nếu tiếp tục nuôi trong môi trường tạo chồi thì ảnh hưởng đến chất lượng cây con nên chúng tôi chọn thời gian nuôi cấy giai đoạn (1) là 30 ngày.

Hình 2. Tái sinh cây lan kim tuyến thông qua PLBs
a: Thể chồi nguyên liệu; b: Thể chồi khử đỉnh; c: PLBs 30 ngày sau nuôi cấy trong môi trường Pr4; d-e: Thể chồi tái sinh từ PLBs sau 10, 30 ngày nuôi cấy trên môi trường K1 (giai đoạn 1); f-g: Chồi lan kim tuyến sau 60, 90 ngày nuôi cấy trên môi trường K0 ( giai đoạn 2); h: cây lan kim tuyến trồng thủy canh trên giá thể xơ dừa.
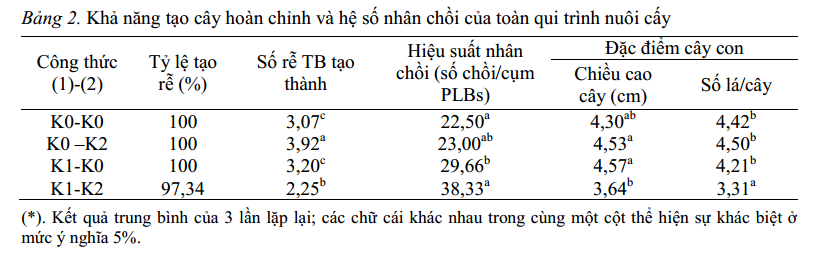
Bảng 2. Khả năng tạo cây hoàn chỉnh và hệ số nhân chồi của toàn qui trình nuôi cấy
Trong giai đoạn (2), chúng tôi tách cụm chồi (3-4 chồi) từ cụm chồi đã tái sinh từ một cụm PLBs thu được ở giai đoạn (1) chuyển sang môi trường K0 hoặc K2 để chồi tiếp tục sinh trưởng. Sau 30 ngày nuôi cấy đầu tiên, chúng tôi tiến hành tách riêng từng chồi và chuyển sang cùng môi trường để chồi sinh trưởng và ra rễ.
Trong quá trình tiến hành thí nghiệm, chúng tôi nhận thấy, môi trường không bổ sung chất điều hòa sinh trưởng K0 cũng có khả năng cảm ứng tạo rễ ở các chồi lan kim tuyến. Do đó, chúng tôi tiến hành nuôi cấy các chồi riêng biệt trên cả hai môi trường K0 và K2 trong giai đoạn (2). Giai đoạn (2) kéo dài trong 60 ngày. Kết quả theo dõi sau 90 ngày được thể hiện ở bảng 2.
Kết quả cho thấy, khi tách chuyển các cụm chồi nuôi cấy trong hai môi trường K0 và K1 ở giai đoạn (1) vào cùng một môi trường tạo rễ (K0 hoặc K2) ở giai đoạn (2), hệ số tạo chồi có sự sai khác lớn. Khi chuyển các cụm chồi từ nuôi cấy trong môi trường K0 sang môi trường sinh trưởng và tạo rễ K0 không thấy có sự sai khác nhiều về hiệu quả tạo chồi. Nguyên nhân có thể do môi trường tái sinh chồi K0 (không bổ sung chất điều hòa sinh trưởng) các cytokinin ngoại sinh được cây sử dụng hết trong giai đoạn (1), sau 30 ngày nuôi cấy chuyển sang môi trường sinh trưởng chồi và tạo rễ K0 hoặc K2 (không bổ sung chất điều hòa sinh trưởng thuộc nhóm cytokinin) trong mẫu cấy chỉ còn cytokinin nội sinh, nên ở giai đoạn này cây gần như không tạo thêm chồi công thức K0-K0 có hiệu suất nhân cây là 22,5 trong khi kết quả tương tự từ công thức K0-K2 là 23,00).
Bên cạnh đó, các chồi tạo thành có chất lượng đồng đều. Điều này thể hiện ở chiều cao chồi và số lá/cây giữa 2 công thức không có sai khác rõ rệt (bảng 2). Tuy nhiên, việc bổ sung 0,5 mg/l NAA ở môi trường K2 cho số lượng rễ/chồi (3,92 rễ/chồi ) cao hơn ở môi trường K0 (3,07 rễ/chồi). Khi chuyển các cụm chồi từ môi trường K1 ở giai đoạn (1) sang môi trường K2 hay K0 đều có hiệu suất nhân cây (số cây/cụm PLBs) cao hơn các cụm chồi được chuyển từ môi trường K0. Hiệu suất nhân cây tăng do trong 30 ngày đầu giai đoạn (2), các cụm chồi được tách từ môi trường K1 vẫn tiếp tục tạo chồi (hình 2f).
Hiện tượng này có thể do khi chồi sinh trưởng trong môi trường tái sinh chồi K1 (bổ sung chất điều hòa sinh trưởng thuộc nhóm cytokinin) khi chuyển sang môi trường mới ở giai đoạn (2) các cụm chồi vẫn còn dư lượng chất kích thích cytokinin nên tiếp tục hình thành chồi nách, đồng thời kéo dài hết các chồi bắt đầu hình thành từ môi trường tái sinh chồi mà chưa đếm được. Công thức K1-K2 cho hiệu suất nhân cây cao nhất 38,33 cây. Tuy nhiên, cây con tạo thành có chất lượng thấp (số rễ/cây, chiều cao cây, số lá/cây ít và không đồng đều) không đủ điều kiện đưa ra vườn ươm. Trong khi đó, công thức K1-K0 sau 60 ngày nuôi cấy cho chất lượng cây con tốt hơn và đủ tiêu chuẩn đưa ra vườn ươm với hiệu suất nhân cây đạt 29,66 cây/cụm PLBs với 100% chồi tạo rễ và trung bình tạo 3,2 rễ/ chồi, các chồi đạt chiều cao trung bình 4,57cm và có 4,21 lá/cây (hình 2g).
Nguồn: Trần Thị Hồng Thúy, Đỗ Thị Gấm, Nguyễn Khắc Hưng, Phạm Bích Ngọc, Chu Hoàng Hà (2015), Nghiên cứu nhân giống nhanh In vitro loài Lan kim tuyến (Anoectochilus setaceus Blume) thông qua cảm ứng tạo protocorm like bodies, Tạp chí Sinh học, 37(1), tr.76-83 .