Nguyễn Thị Xuân Thu, Đặng Đức Long, Thành Thị Thu Thuỷ
TAP CHI SINH HOC 2019, 41(2): 119–128 DOI: 10.15625/0866-7160/v41n2.13783
TÓM TẮT
Nghiên cứu này nhằm đánh giá tác dụng hạ đường huyết của dịch chiết cồn 70o của lá dây thìa canh, lá cỏ ngọt, vỏ quế, râu bắp và lá húng quế trên chuột ĐTĐ (đái tháo đường) gây ra bởi streptozocin. ết quả chứng minh rằng cao lá dây thìa canh và lá cỏ ngọt có khả năng hạ đuờng huyết đáng kể ở liều 5 mg kg so với nhóm chuột đối chứng (P< 0,05). Trong đó, chuột uống cao lá dây thìa canh và cỏ ngọt đường huyết tại thời điểm ngày thứ 21 giảm 57,68% và 54,93% so với thời điểm giờ. Khả năng ức chế hoạt động của enzyme α-amylase và α- glucosidase của cao cồn lá dây thìa canh và cỏ ngọt cũng đuợc khảo sát in vitro. Kết quả cho thấy cao chiết cồn của dây thìa canh và cỏ ngọt Việt Nam đều có khả năng ức chế mạnh hoạt động của enzyme α-glucosidase và enzyme α-amylase, với các giá trị IC50 thấp hơn các giá trị công bố gần đây trên thế giới khoảng 2−5 lần. Thêm vào đó, kết quả đo tính chống oxy hoá với 1,1-diphenyl-2-picrylhydrazyl (DPPH) cho thấy cao chiết lá dây thìa canh và lá cỏ ngọt thể hiện hoạt tính chống oxy hóa tương đối thấp với nồng độ mẫu cần thiết để quét 50% gốc tự do DPPH là 115,88 µg/mL và 160,27 µg/mL so với vitamin C (49,16 ± 1,26 µg/mL).
MỞ ĐẦU
Đái tháo đường (ĐTĐ) là một nhóm các rối loạn chuyển hóa được đặc trưng bởi nồng độ glucose trong máu tăng cao do hậu quả của sự thiếu hụt hoặc giảm hoạt động của insulin (Baynest et al., 2015). Tăng đường huyết trong thời gian dài có liên quan đến các biến chứng vi mạch dẫn đến các bệnh tim mạch, đột quỵ, mù và bệnh thận (Asmat et al., 2016).
Một phương pháp điều trị thực tế để kiểm soát bệnh tiểu đường là kiểm soát tăng đường huyết sau ăn. Điều này có thể đạt được bằng cách ức chế các enzyme thủy phân carbohydrate như α-amylase và α-glucosidase có trong đường tiêu hóa. Người ta biết rằng trong tình trạng bệnh đái tháo đường, α-glucosidase và α-amylase có thể gây bất lợi, do khiếm khuyết sinh hóa khiến nồng độ glucose trong máu tăng cao (Baskaran et al.,1990).
Việc ức chế α-glucosidase và α-amylase có thể làm giảm đáng kể sự gia tăng đường huyết sau ăn do chỉ có thể hấp thụ monosacarit qua niêm mạc ruột, do đó làm giảm nhu cầu insulin và do đó đóng vai trò quan trọng trong việc kiểm soát mức đường huyết ở bệnh nhân tiểu đường (El-Manawaty et al., 2015). Thuốc ức chế α-glucosidase, acarbose, cải thiện độ nhạy cảm với insulin và giảm đường huyết sau ăn. Tuy nhiên, tác dụng phụ thường gặp nhất được quan sát bằng liệu pháp acarbose là các triệu chứng tiêu hóa (Ruiz-Ruiz et al., 2015).
Có một số yếu tố khác đóng vai trò lớn trong sinh bệnh học của bệnh ĐTĐ như tăng lipid máu và stress oxy hóa dẫn đến nguy cơ biến chứng cao. tress oxy hóa dẫn đến sự tạo thành các gốc tự do trong cơ thể và đây chính là nguyên nhân chủ yếu dẫn đến kháng insulin, rối loạn lipid máu, rối loạn chức năng tế bào, giảm dung nạp glucose và cuối cùng dẫn đến bệnh ĐTĐ type 2 (Dhasarathan et al., 2011). Bằng cách bổ sung các chất chống oxy hóa tự nhiên có trong thực vạt sẽ có tác dụng ngăn chặn sự tiến triển của bệnh ĐTĐ do các chất chống oxy hóa này có khả năng làm sạch các gốc tự do có hại cho cơ thể từ sự stress oxy hóa (El-Hashash et al., 2010).
Trong y học hiện đại, tác dụng có lợi của thuốc đối với mức độ đường huyết đã được ghi nhận rõ ràng nhưng các loại thuốc này thường quá đắt hoặc có tác dụng phụ nhất định. Do đó, để điều trị bệnh đái tháo đường, nhiều loại cây thuốc truyền thống đã được ưa chuộng làm nguồn thuốc tự nhiên (Tangvarasittichai, 2015) vì chúng được coi là an toàn, ít độc hơn so với thuốc tổng hợp (Ramesh et al., 2006). Bênh cạnh đó, cây thảo dược thường có hoạt tính chống oxy hóa mạnh do vậy các loại cây này trở nên có nhiều hiệu quả hơn trong phòng chống lại bệnh ĐTĐ. Hơn 4 loài thực vật có hoạt động hạ đường huyết đã được công bố, tuy nhiên, tìm kiếm các loại thuốc trị đái tháo đường mới từ thực vật tự nhiên vẫn luôn hấp dẫn vì chúng có chứa những hợp chất có khả năng thay thế và an toàn trong điều trị tiểu đường.
Đã có rất nhiều loại thảo dược được nghiên cứu và chứng minh tác dụng hạ đường huyết như: thổ phục linh, dây thìa canh, trà xanh, khổ qua, quế, giảo cổ lam… Hầu hết các thảo dược đều chứa các thành phần như: Glycosides, alkaloid, terpenoid, flavonoid, carotenoid… có tác dụng tốt trong điều trị hạ đường huyết và chống oxy hoá (Patel et al., 2012). Trong nghiên cứu này, ngoài tác dụng hạ đường huyết của dây thìa canh đã được nghiên cứu trước đó ở Việt Nam, các công trình nghiên cứu về tác dụng hạ đường huyết của các cây cỏ ngọt, húng quế, quế, râu bắp là hầu như rất hiếm ở Việt Nam. Kết quả khả năng kiểm soát đuờng huyết của các cao chiết đuợc chứng minh trên chuột ĐTĐ cũng như khả năng chống oxy hoá của các cao chiết cũng đuợc nghiên cứu và so sánh với các kết quả được công bố gần đây trên thế giới.
Các kết quả thu được từ nghiên cứu này sẽ góp phần khẳng định tác dụng chống ĐTĐ của một số loại thảo dược ở Việt Nam, đặc biệt của lá dây thìa canh và lá cỏ ngọt. Việc sử dụng cao chiết cồn của các loại thảo dược này để thử hoạt tính ức chế α-glucosidase và α-amylase là một đóng góp mới, góp phần tạo ra các thuốc đặc hiệu hơn để chống bệnh tiểu đường từ nguồn dược liệu Việt Nam.
NGUYÊN LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Nguyên liệu
Mẫu thực vật được thu mua tại một cơ sở thuốc bắc ở thành phố Đà Nẵng vào khoảng tháng 8−9. Mẫu được sấy khô ở 50oC, xay thành bột làm nguyên liệu.

Hình ảnh dây Thìa canh
Hóa chất sử dụng trong thí nghiệm gồm: Ethanol, STZ (streptozotocin) của hãng Sigma.
- Hóa chất dùng pha đệm đạt độ tinh khiết: Đệm citrate 0,01 M, pH 4.
- Thuốc điều trị đái tháo đường Pioglite (Ấn độ). Enzyme α-glucosidase, α- amlylase, thuốc Acarbose 100 mg, DNSA (3,5-dinitrosalicylic acid), p-nitrophenyl-α-D glucopyranoside (pNPG) .
- Tinh bột, Dimethyl sulfoside (DMSO) và một số hóa chất khác mua của các hãng hóa chất Việt Nam.
Đối tượng nghiên cứu: Chuột nhắt trắng đực dòng Swiss, khối lượng từ 18–22 g.
Phương pháp nghiên cứu
Cất các mẫu thực vật:
Bột khô khoảng 500 g từ năm mẫu thực vật (lá dây thìa canh, lá cỏ ngọt, vỏ quế, lá húng quế, râu bắp) được chiết với cồn 70o. Tiến hành cô quay các dịch chiết thu được cao cồn tổng.
- Các cao chiết này được thử nghiệm cho hoạt động hạ đường huyết trên mô hình chuột đái tháo đường cũng như khảo sát khả năng ức chế enzyme α-glucosidase, α-amlylase và chống oxy hoá.
Nghiên cứu tác dụng của dịch chiết trên chuột đái tháo đường:
Chuột sau 8 tuần cho ăn thức ăn béo đuợc tiêm dung dịch STZ ở nồng độ 120 mg/kg khối luợng chuột để gây bệnh ĐTĐ (Sawant et al., 2006). Sau khi chuột ĐTĐ ổn định 1 ngày, khả năng hạ đuờng huyết của các cao chiết thực vật được xác định bằng cách cho chuột ĐTĐ uống thuốc điều trị ĐTĐ Pioglite (20 mg/kg khối luợng chuột) hoặc các cao chiết (500 mg/kg khối luợng chuột) hoặc không được uống thuốc hay các cao chiết thực vật.
- Chuột ĐTĐ uống cao chiết trong 21 ngày điều trị. Đuờng huyết đuợc xác định vào 7−8 giờ sáng trước khi chuột được cho ăn. Sau khi đo các chỉ tiêu chuột được cho ăn và uống nước bình thuờng.
Nghiên cứu khả năng ức chế hoạt động của enzyme α- glucosidase:
Nghiên cứu khả năng ức chế hoạt động của enzyme α- glucosidase bởi các cao chiết thực vật được thực hiện theo phương pháp của Salehi và cộng sự (Salehi et al., 2013) có hiệu chỉnh.
- Mỗi thử nghiệm được thực hiện lặp lại ba lần. Nồng độ của dịch chiết cần thiết để ức chế 50% hoạt tính α-glucosidase trong điều kiện khảo nghiệm được xác định là giá trị IC50.
Nghiên cứu khả năng ức chế enzym α-amylase:
Phản ứng ức chế sự thủy phân tinh bột của enzyme α-amylase bởi các cao chiết được thực hiện theo phương pháp của Manaharan và cộng sự (Manaharan et al., 2012) có hiệu chỉnh.
- Tất cả các phép đo đều được thực hiện trong ba lần.
- Mẫu đối chứng dương được thực hiện bằng thuốc Acarbose.
Xác định khả năng chống oxy hóa:
Hoạt động chống oxy hoá của các cao chiết từ các mẫu thực vật khác nhau được thực hiện theo quy trình của Shirwaikar và cộng sự (Shirwaikar et al., 2006) có hiệu chỉnh
- Thí nghiệm được lặp lại ba lần, tính kết quả trung bình.
- Lập đồ thị biểu hiện mối tương quan giữa SC và thể tích mẫu thử đã dùng, từ đó tính được giá trị SC50 của mẫu thử.
KẾT QUẢ VÀ THẢO LUẬN
Khả năng hạ đường huyết của các cao chiết trên mô hình chuột ĐTĐ
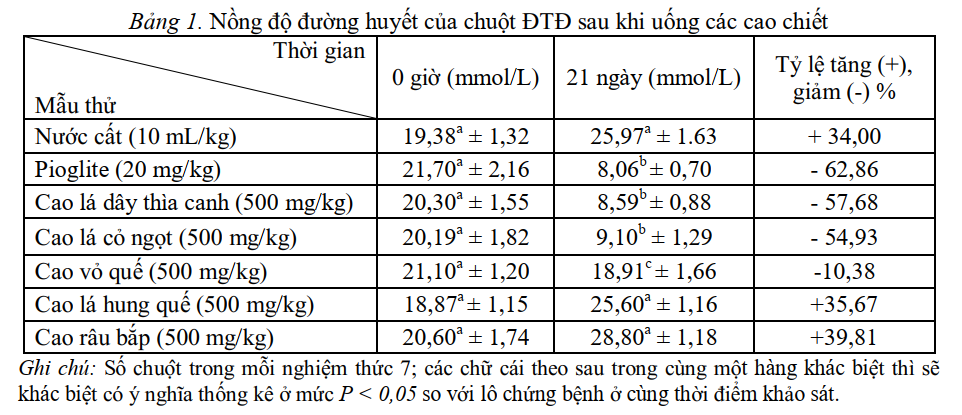
Từ bảng 1 có thể thấy chuột bị bệnh ĐTĐ type 2 ở lô đối chứng chỉ cho uống nước cất thì sau 21 ngày nồng độ đường huyết không giảm, thậm chí còn tăng khi so với thời điểm trước khi điều trị.
Nhóm chuột ĐTĐ được điều trị bằng thuốc pioglite (2 mg kg), nồng độ đuờng huyết giảm có ý nghĩa thống kê khi so với nhóm đối chứng ở cùng thời điểm (giá trị P < 0,05), và sau 21 ngày uống thuốc nồng độ đuờng huyết giảm 62,86%.
Còn trong số 5 mẫu cao chiết thực vật khác nhau được thử nghiệm khả năng hạ đường huyết chỉ có mẫu cao dây thìa canh và cao lá cỏ ngọt thể hiện hoạt tính hạ đường huyết tốt nhất: chuột uống cao dây thìa canh đường huyết tại thời điểm ngày thứ 21 giảm 57,68%, chuột uống cao lá cỏ ngọt giảm 54,93% (giá trị P < 0,005) so với thời điểm 0 giờ.
- Cụ thể nồng độ đường huyết của nhóm chuột ĐTĐ type 2 cho uống cao chiết dây thìa canh tại thời điểm ngày thứ 21 là 8,59 ± 0,88 mmol/L.
- Nhóm uống cao chiết cỏ ngọt là 9,10 ± 1,29 mmol/L.
Nhận xét:
Các nghiên cứu của các tác giả trong và ngoài nước ngoài đã chứng minh dây thìa canh có tác dụng hiệu quả trong hạ đường huyết ở chuột ĐTĐ (Trần Van Ơn và nnk., 2014; Baskaran et al., 1990).
- Nghiên cứu tác dụng hạ đường huyết của cỏ ngọt ở Việt Nam còn rất hạn chế, tuy nhiên đã có một số nghiên cứu trên thế giới chứng minh được hoạt tính sinh học cũng như thành phần hoá học của cỏ ngọt.
- Ahmad và cộng sự đã chỉ ra rằng cỏ ngọt có khả năng làm giảm nồng độ đường huyết (66, 9% ) và glycohemoglobin (5,32% ) đáng kể, bên cạnh đó, mức insulin và glycogen gan cũng được cải thiện ở chuột ĐTĐ (Ahmad et al., 1990 ).
Khả năng ức chế enzyme α-amylase và α-glucosidase của các cao chiết
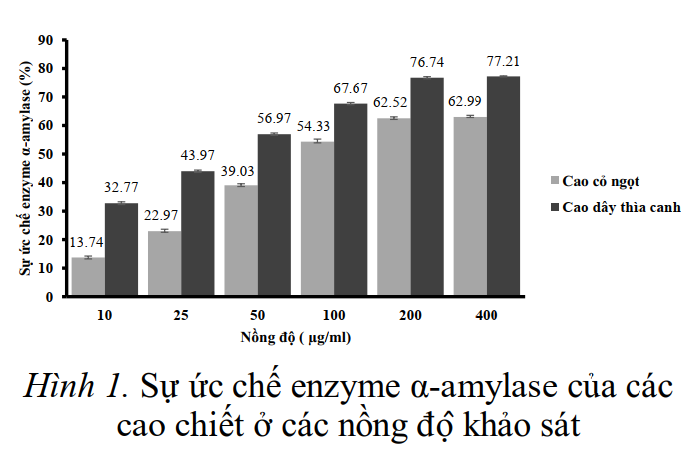
Khả năng ức chế enzyme α-amylase của các cao chiết dây thìa canh và cỏ ngọt được trình bày ở hình 1.
Nhận xét:
Sự ức chế enzyme α-amylase của cao dây thìa canh và cỏ ngọt tỷ lệ tuyến tính với nồng độ cao chiết, khi tăng nồng độ cao chiết thì khả năng ức chế enzyme α-amylase càng cao đến khu vực nồng độ của cao chiết đạt 200 μg/mL.
Điều này được chứng tỏ qua khả năng ức chế của cả cao dây thìa canh và cao cỏ ngọt ở nồng độ 400 μg/mL thể hiện mức độ ức chế tương đương ở nồng độ 200 μg/mL (hình 1). Do đó có thể kết luận đối với cao cỏ ngọt sự ức chế enzyme α-amylase cao nhất đạt được ở nồng độ 200 μg/mL (mức độ ức chế là 62,52%).
Tương tự với cao thìa canh, sự ức chế enzyme α-amylase cao nhất ở nồng độ cao chiết 200 μg/mL đạt 76,74% và khu vực nồng độ tăng khả năng ức chế enzyme là từ 10–200 μg/mL.
Sự ức chế enzyme α-glucosidase
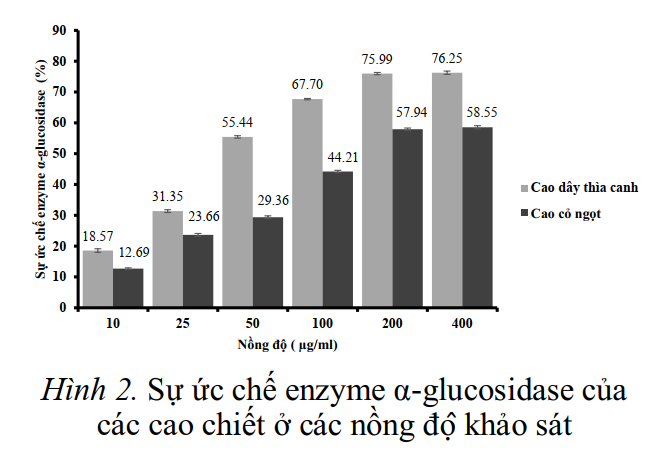
Kết quả về sự ức chế enzyme α-glucosidase của các cao chiết từ dây thìa canh và cỏ ngọt được trình bày ở hình 2.
Nhận xét:
Khả năng ức chế enzyme α-glucosidase của cả cao dây thìa canh và cao cỏ ngọt ở nồng độ 400 μg/mL thể hiện mức độ ức chế tương đương ở nồng độ 200 μg/mL (hình 2). Ở nồng cao chiết 400 μg/mL và 200 μg/mL cao dây thìa canh thể hiện hoạt tính ức chế cao hơn so với các nồng độ cao còn lại lần lượt là: 76,25 ±
0,54% và 75,99 ± 0,37%. Cao cỏ ngọt có hoạt tính ức chế enzyme α-amylase thấp hơn, ở nồng độ 200 μg/mL và 400 μg/mL ức chế 57,94 ± 0,38% và 58,55 ± 0,52%.
Khả năng ức chế của các cao chiết lá dây thìa canh và lá cỏ ngọt với enzyme α-amylase và α-glucosidase đuợc xác định bằng nồng độ ức chế 50% (IC50) đuợc trình bày trong bảng 2. Lưu ý rằng khi tính giá trị IC50, chúng tôi chỉ sử dụng khu vực thay đổi tuyến tính của nồng độ ức chế (10–200 μg/mL) để đảm bào tính chính xác.
Kết quả về giá trị IC50 đối vói enzyme α-amylase cho thấy cao dây thìa canh có giá trị IC50 nhỏ nhất (IC50 = 32,97 ± ,9 μg/mL), tiếp đến là cao cỏ ngọt với giá trị IC50 = 92,70 ± 1,54 μg/mL. Các giá trị này thấp hơn so với báo cáo trước đây về chiết xuất quế (IC50 = 130,55 μg/mL), sa kê (IC50 = 118,88 μg/mL), trầu không (IC50 = 94,63 μg/mL) (Nair et al.,2013).
Khả năng ức chế hoạt động của enzyme α-glucosidase của cao dây thìa canh là tương đối tốt với IC50= 48,27 ± 0,84 μg/mL, trong khi đó cao cỏ ngọt có giá trị IC50 cao hơn (IC50 = 143,67 ± 2,5 μg/mL). Nair và
cộng sự đã báo cáo các giá trị IC50 lần lượt là 129,85; 140,01 và 96,56 μg/mL đối với các chất chiết xuất từ sa kê, quế và trầu không (Nair et al., 2013). Với các giá trị IC50 cao chiết dây thìa canh thấp hơn các cây khác như vậy gợi ý rằng cao chiết dây thìa canh là nguồn dược liệu tốt để ức chế enzyme α-amylase và α-glucosidase. Đặc biệt hơn nữa, các kết quả của nghiên cứu này sử dụng nguồn nguyên liệu ở Việt Nam có kết quả thấp hơn nhiều các kết quả được công bố gần đây trên thế giới.
Đối với dây thìa canh, Ibrahim và cộng sự (Ibrahim et al., 2 17) đã kiểm tra với cao chiết methanol và thu được giá trị IC50 cho α-amylase là 195,3 ± 4,40 μg/mL và cho α-glucosidase là 182,26 ± 1,05 μg/mL. Các giá trị này cao hơn giá trị các IC50 cho α-amylase và α-glucosidase mà chúng tôi thu được với cao chiết cồn của dây thìa canh lần lượt là 5,9 và 3,8 lần. Trong khi đó, kết quả IC50 cho α-amylase và α-glucosidase của
mẫu kiểm chứng (acabose) mà chúng tôi thu được là 203,15 ± 3,0 μg/mL và 188,76 ± 1,47 μg/mL cũng tương đương với kết quả kiểm chứng cho acabose của Ibrahim và cộng sự (lần lượt là 200,05 ± 7,16 và 189,52 ± 0,46 μg/mL). Điều này chứng tỏ kết quả sai khác lớn mà chúng tôi thu được ở đây không phải là do sai khác về kỹ thuật đo. Kết quả sai khác này có thể có nguyên nhân từ sự khác nhau về nguồn nguyên liệu, giữa cây dây thìa canh ở Việt Nam và dây thìa canh ở Nigeria trong nghiên cứu của Ibrahim và cộng sự. Một
nguyên nhân khác có thể do chúng tôi dùng cao chiết cồn còn nghiên cứu trên dùng cao chiết methanol. Đối với cây cỏ ngọt, RuizRuiz và cộng sự (Ruiz-Ruiz et al., 2 15) đã kiểm tra với cao chiết nước nóng và thu được
giá trị IC50 cho α-amylase là 198,4 μg/mL và cho α-glucosidase là 596,77 μg mL. Các giá trị này cao hơn giá trị các IC50 cho α-amylase và α-glucosidase mà chúng tôi thu được với cao chiết cồn của cỏ ngọt lần lượt là 2,1 và 4,2 lần. Các giá trị khác biệt lớn như vậy cũng chỉ có thể do sự khác biệt về nguyên liệu ở Việt Nam và ở Mexico (trong nghiên cứu của Ruiz-Ruiz và cộng sự), và có thể do sự khác biệt về phương pháp chiết. Tuy vậy, theo các tài liệu về tách chiết hợp chất thiên nhiên, thì giữa việc dùng nước nóng và cồn để chiết thì
ít khi có sự khác biệt nhiều về thành phần dịch chiết. Vậy sự khác biệt lớn phần nhiều là do sự khác biệt về nguồn nguyên liệu thiên nhiên.
Từ các kết quả trình bày trên cho thấy cao chiết từ dây thìa canh và cỏ ngọt của Việt Nam có khả nang điều trị bệnh ĐTĐ theo co chế ức chế tốt hoạt đọng của enzyme thủy phân tinh bọt là α-amylase và α-glucosidase.
Kết quả của nghiên cứu này bổ sung cơ sở khoa học cho y học cổ truyền về khả năng điều trị bệnh ĐTĐ của cao chiết dây thìa canh và cỏ ngọt của Việt Nam.
Hoạt tính kháng oxy hóa bằng phương pháp DPPH
Nguyên nhân của phần lớn các tình trạng bệnh như xơ vữa động mạch, tăng huyết áp, bệnh Alzheimer’s, arkinson, ung thư, đái tháo đường và các bệnh viêm nhiễm đang được coi chủ yếu là do sự mất cân bằng nội
môi giữa quá trình tạo ra các gốc tự do (quá trình oxy hóa) và quá trình sản sinh ra các chất chống oxy hóa (Shirwaikar et al., 2013).
Nhiều nghiên cứu đã chứng minh rằng thực vật có khả năng chống oxy hoá rất tốt, chất chống oxy hóa tự nhiên từ thảo dược, đặc biệt là phenolic và flavonoid là an toàn, chúng bảo vệ cơ thể con người bằng việc loại bỏ các gốc tự do (Pal et al., 2011). Xác định khả năng chống oxy hoá bằng phương pháp DPPH là phương pháp đơn giản, nhanh chóng và ít tốn kém. Trong những năm gần đây phương pháp này cũng đuợc sử dụng để định luợng chất chống oxy hóa trong các hệ thống sinh học phức tạp (Prakash 2000). Các kết quả của hoạt động chống oxy hóa của các cao chiết đã được thể hiện trong phần trăm quét gốc tự do (SC%).
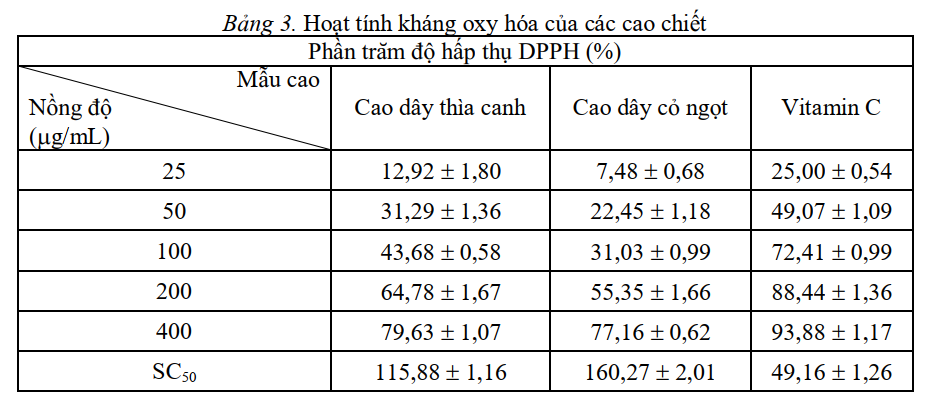
Nhận xét:
Kết quả thí nghiệm ở bảng 3 cho thấy khả năng làm sạch gốc tự do tỷ lệ thuận với nồng độ của các cao chiết, nồng độ của cao chiết càng cao thì khả năng làm sạch gốc tự do càng lớn và ngược lại. Nhìn chung, khả năng quét gốc tự do DPPH ở nồng độ 25 µg/mL chỉ đạt 12,92 ± 1,80% và 7,48 ± 0,68% trong cao chiết dây thìa canh và cỏ ngọt.
Trong khi đó, ở nồng độ 400 µg/mL độ hấp thụ DPPH của dây thìa canh là 79,63 ± 1,07% và thấp hơn là
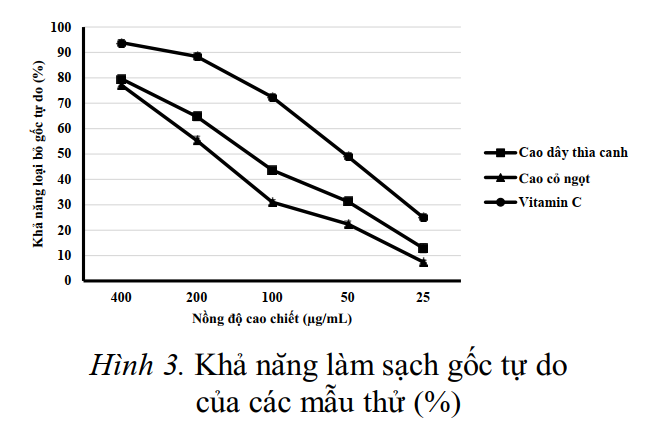
cỏ ngọt 77,16 ± 0,62%. Khả năng làm sạch 5 các gốc tự do SC50 đuợc tính toán dựa vào đồ thị (hình 3) và
kết quả đuợc trình bày trong bảng 3. Trong đó vitamin C có khả năng làm sạch gốc tự do cao hơn ( C50= 49,16 ± 1,26 µg/mL) so với cao lá dây thìa canh (SC50=115,88 ± 1,16 µg/mL) và cao lá cỏ ngọt (SC50 = 160,27 ± 2,01 µg/mL).
Hoạt chất chống oxy hóa của dây thìa canh và cỏ ngọt có thể là đóng vai trò quan trọng về tác dụng có lợi của nó trong điều trị bệnh ĐTĐ (Ahmad et al., 2018).
 Nhận xét:
Nhận xét:
Cao chiết của lá dây thìa canh thu được từ kỹ thuật tách chiết khác nhau cũng được sử dụng để khảo sát khả năng làm sạch gốc tự do DPPH theo nghiên cứu của Kaskoos và cộng sự (Kaskoos et al., 2015) cững phù hợp vói giá trị SC50 của cao lá trong nghiên cứu này.
SC50 của cao lá cỏ ngọt trong phản ứng DPPH theo nghiên cứu của Ruiz-Ruiz và cộng sự (Ruiz-Ruiz et al., 2015) cao hơn (335,94 μg/mL) so với cao lá sử dụng trong thí nghiệm này, nguyên nhân có thể cao chiết
sử dụng trong thí nghiệm của Ruiz-Ruiz và cộng sự là cao nước nóng.
KẾT LUẬN
Trên cơ sở nghiên cứu khả năng hạ đường huyết của các cao chiết thực vật lên chuột ĐTĐ, với kết quả đạt được chúng tôi đưa ra một số kết luận như sau:
- Cao chiết lá dây thìa canh và lá cỏ ngọt có tác dụng hạ đường huyết ở chuột ĐTĐ sau 21 ngày uống với liều 500 mg/kg. Trong đó cao chiết dây thìa canh và cỏ ngọt có hoạt tính hạ đường huyết khá cao lần lượt là 57,68% và 54,93%.
- Cao chiết lá dây thìa canh có khả năng ức chế enzyme α-amylase và α-glucosidase cao với IC50 tương ứng là 32,97 ± 0,90 µg/mL và 48,27 ± 0,84 µg/mL, trong khi đó cao chiết lá cỏ ngọt có khả năng ức chế hai enzyme này thấp hơn với IC50 lần lượt là 92,70 ± 1,54 µg/mL và 143,67 ± 2,50 µg/mL. Các giá trị
này tốt hơn nhiều các giá trị tương ứng đã được công bố trên thế gi i gần đây, góp phần khẳng định đặc tính tốt của nguồn nguyên liệuthiên nhiên của Việt Nam để ứng dụng làm dược liệu chống bệnh ĐTĐ. - Cao chiết dây thìa canh và cỏ ngọt thể hiện hoạt tính chống oxy hóa tương đối thấp với nồng độ mẫu cần thiết để quét 50% gốc tự do DPPH tương ứng là 115,88 ± 1,16 µg/mL và 160,27 ± 2,01 µg/mL so với vitamin C (49,16 ± 1,26 µg/mL).
